聯系我們
地址: 上(shàng)海市徐彙區(qū)東安路8号青松城商務樓701室
電(diàn)話(huà): 021-6151 3876
手機: 189-1400-0129
郵箱: sh_yyjk@163.com
什麽是PD-1/PD-L1
程序性細胞死亡分子1(programmed cell death-1,PD-1)是近年來(lái)發現的一種負性共刺激分子。程序性細胞死亡配體(tǐ)1(programmed cell death-Ligand 1,PD-L1)是PD-1的配體(tǐ),PD-1與PD-L1結合後可(kě)提供抑制(zhì)性信号,誘導T細胞凋亡,抑制(zhì)T細胞的活化和(hé)增殖。PD-1和(hé)PD-L1廣泛表達于多(duō)種腫瘤細胞,當受體(tǐ)與配體(tǐ)結合可(kě)抑制(zhì)下遊NF-κB的轉錄并促使幹擾素-δ分泌的下調,最終抑制(zhì)T細胞免疫,導緻免疫抑制(zhì)性腫瘤微環境形成,使腫瘤細胞逃避機體(tǐ)的免疫監控和(hé)殺傷。而阻斷PD-1/PD-L1信号通(tōng)路可(kě)以逆轉腫瘤免疫微環境,恢複T細胞的抗腫瘤活性,從而增強內(nèi)源性抗腫瘤免疫效應。
PD-1抑制(zhì)劑治療腫瘤的效果與生(shēng)物标記物之間(jiān)的關聯
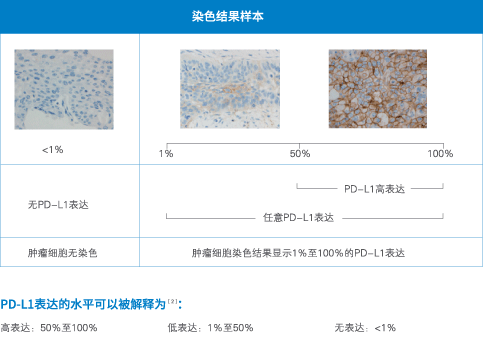
在許多(duō)腫瘤免疫治療的早期研究中發現,對于免疫組化(IHC)檢測出的PD-L1蛋白高(gāo)表達的腫瘤組織相比于PD-L1表達呈陰性或是低(dī)表達量的腫瘤組織而言,腫瘤對免疫檢查點抑制(zhì)劑(這裏是PD-1抑制(zhì)劑)具有(yǒu)更高(gāo)的應答(dá)率。NCCN腫瘤臨床實踐指南(NCCN指南(R))推薦,PD-L1檢測是轉移性非小(xiǎo)細胞肺癌(NSCLC)患者治療過程中診斷評估的重要部分。所有(yǒu)被診斷為(wèi)鱗狀細胞或非鱗狀細胞的NSCLC患者都需要檢測PD-L1表達[2]。
何時(shí)檢測?如何檢測?
1、PD-L1蛋白在多(duō)種類型的腫瘤細胞上(shàng)都有(yǒu)表達的免疫調控相關生(shēng)物标記,其中包括NSCLC。
2、在鱗狀細胞以及非鱗狀細胞NSCLC患者的腫瘤中檢測其PD-L1表達量可(kě)能有(yǒu)助于更好地了解患者的腫瘤,并且有(yǒu)助于确定治療方案。
3、PD-L1表達量有(yǒu)助于識别可(kě)能獲得(de)檢查點抑制(zhì)劑最大(dà)獲益的患者群體(tǐ)。
4、在診斷期對患者進行(xíng)PD-L1表達量檢測,同時(shí)進行(xíng)組織學亞型分類檢測。
5、診斷期未進行(xíng)檢測的患者,在使用二線治療方案或更優治療方案前進行(xíng)檢測可(kě)對決定治療方案起到參考作(zuò)用。
用什麽樣本進行(xíng)檢測?
1、PD-L1檢測的組織樣本與其他免疫組化檢測的樣本制(zhì)備方法一緻。
2、福爾馬林固定,石蠟包埋的樣本可(kě)用于檢測。
3、組織标本厚度應該在3-4毫米之間(jiān),在10%中性福爾馬林緩沖液內(nèi)固定12-72小(xiǎo)時(shí),經一系列酒精和(hé)二甲苯脫水(shuǐ)、透明(míng),然後在不超過60o的熔化石蠟內(nèi)浸蠟。
4、将蠟塊切割成為(wèi)4-5微米厚的切片并粘附于防脫玻片上(shàng),在2-8oC中避光保存以保存抗原,應在6個(gè)月內(nèi)對切片進行(xíng)染色。
5、每例待檢标本應至少(shǎo)提供 5 張連續切片:1張用于HE染色,1張用于IHC檢測、1張用于試劑陰性對照,其餘備用。
檢測試劑盒抗體(tǐ)
基于以上(shàng)機理(lǐ),我們提及的PD-L1的檢測是基于細胞蛋白水(shuǐ)平的檢測,因此臨床試驗中以免疫組化方法為(wèi)主。也就是大(dà)家(jiā)在手術(shù)或穿刺後取得(de)的腫瘤組織進行(xíng)切片染色,通(tōng)常在病理(lǐ)報告中顯示。免疫組化是檢測蛋白表達的經典手法,其通(tōng)過抗體(tǐ)着色後由病理(lǐ)醫(yī)師(shī)鏡下觀察根據着色深淺來(lái)評價表達情況。因此除了染色技(jì)術(shù)外,抗體(tǐ)的特異性也尤其重要。目前已經上(shàng)市并批準用于NSCLC的三種檢查點抑制(zhì)劑有(yǒu)Keytruda(Pembrolizumab)、Opdivo(Nivolumab)、Tecentriq(Atezolizumab),針對這三種藥物的PD-L1平台檢測抗體(tǐ)分别為(wèi)Dako的22C3、28-8和(hé)Ventana的SP142,其中前兩項為(wèi)FDA批準的試劑盒抗體(tǐ),後一項為(wèi)實驗室研發的檢測方法。
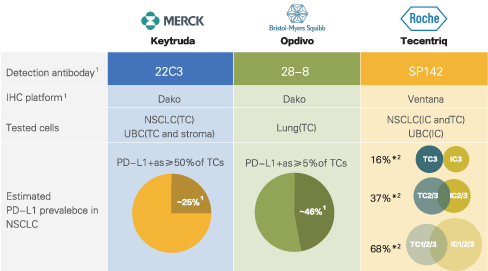
Keytruda(Pembrolizumab)——Dako 22C3抗體(tǐ)
2015年10 月 2 日,美國 FDA 加速批準了默沙東公司(Merck)的Keytruda(pembrolizumab)用于治療晚期(轉移性)非小(xiǎo)細胞肺癌(NSCLC),适用于其它藥物治療後疾病進展及腫瘤表達PD-L1蛋白的患者。數(shù)據顯示,接近九成的PD-L1高(gāo)表達肺癌患者有(yǒu)腫瘤縮小(xiǎo)的情況,為(wèi)晚期肺癌治療的新突破,基于該藥對EGFR陰性、ALK陰性、應用鉑類化療時(shí)和(hé)化療後疾病進展的NSCLC患者的療效,美國FDA授予其突破性治療認定(BTD,breakthrough therapy designation)。由于臨床需要篩選出腫瘤組織PD–L1高(gāo)表達的肺癌患者,對其使用PD-L1抑制(zhì)劑才能最大(dà)獲益,為(wèi)此,FDA批準了Keytruda 與一種伴随診斷檢測 PD-L1 IHC 22C3 pharmDx 一起使用,後者是全球第一個(gè)在非小(xiǎo)細胞肺癌中檢測PD-L1表達的伴随診斷方法,屬于Agilent旗下的Dako公司,采用的是免疫組化IHC方法。Keytruda(R) (Pembrolizumab)治療NSCLC的效果與PD-L1表達的關系,以PD-L1蛋白在腫瘤細胞中的占比百分數(shù)(TPS)為(wèi)參數(shù),臨床試驗數(shù)據顯示[2]。